Aggregatzustände beschreiben den physikalischen „Ist“-Zustand eines Stoffes, beziehungsweise seine Erscheinungsform, abhängig von äußeren Faktoren. Nahezu alle Stoffe existieren in festem, flüssigem und gasförmigem Aggregatzustand, sofern die erforderlichen äußerlichen Bedingungen herrschen. Maßgebliche Einflüsse auf den Aggregatzustand von Stoffen haben Temperatur, Druck und Volumen.
Das bekannteste und einfachste Beispiel für Aggregatzustände und ihre Phasenübergänge ist wahrscheinlich das Wasser. (Fast) jeder Mensch kennt es in seinem festen Zustand als Eis, flüssig als Wasser und gasförmig als Dampf. Aufgrund seiner Stoffeigenschaften lassen sich alle Phasenübergänge des Wassers in Temperatur- und Druckbereichen nachvollziehen, die auch im Alltag regelmäßig erreicht und beobachtet werden können.
Die Aggregatzustände im Teilchenmodell einfacher erklärt
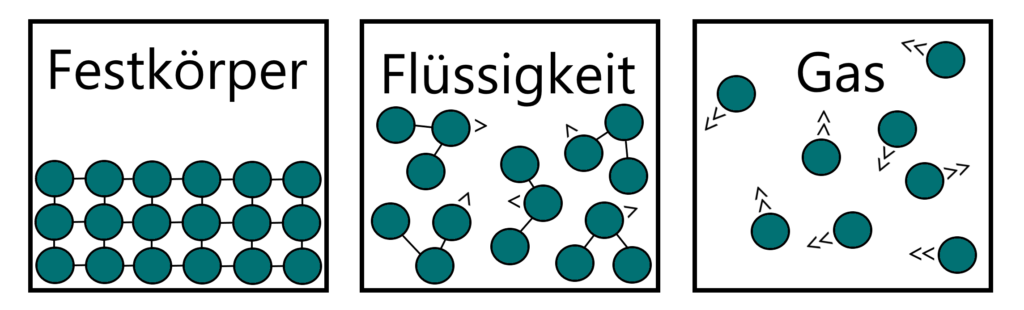
Um Aggregatzustände einfacher erklären zu können, bedient man sich am besten des sogenannten Teilchenmodells. Die kleinste Einheit eines reinen Stoffes wird hier als ein kugelförmiges „Teilchen“ dargestellt, das in Beziehung und Bewegung zu den anderen Teilchen in seiner Umgebung steht. Die Teilchen reiner Stoffe sind identisch zueinander und sind immer mehr oder weniger stark in Bewegung. Üblicherweise gilt, je höher die Temperatur eines Stoffes, desto schneller bewegen sich seine Teilchen.
Die Temperatur bzw. Wärmeenergie macht sich über die Bewegung der kleinsten Teilchen bemerkbar. So gilt die mittlere kinetische Energie aller Teilchen eines Stoffes als Maß für seine Temperatur, unabhängig von seinem Aggregatzustand. Bei höherer Temperatur bewegen sie sich immer schneller und die Anziehungskräfte zwischen den Teilchen können nicht mehr so gut wirken. Kühlen Stoffe ab, verlangsamen sich auch die Teilchen wieder.
Die Energie ist entscheidend für den Aggregatzustand
Der Aggregatzustand eines Stoffes richtet sich daher maßgeblich nach dem Verhältnis von Anziehungskraft und Energie, beziehungsweise der Geschwindigkeit seiner Teilchen. Sie entscheidet, im Zusammenspiel mit Druck, ob ein Stoff fest, flüssig oder gasförmig ist.
Auch die Bewegung der Teilchen unterscheidet sich je nach Aggregatzustand. In einem Festkörper sind die Teilchen nur sehr wenig in Bewegung und befinden sich in einer festen Position. In einer Flüssigkeit bewegen sich die Teilchen noch in Gruppen, bewegen sich ansonsten aber frei und verschieben einander konstant. Im Gas haben die Teilchen die höchste Geschwindigkeit, sie sind jetzt völlig frei und kollidieren regelmäßig miteinander und den Wänden des Raums, in denen sie sich befinden.
Die drei Aggregatzustände: Fest, flüssig und gasförmig
Üblicherweise werden Reinstoffe nach ihrem Aggregatzustand bei Raumtemperatur (20°C) und Normaldruck (1013,25 hPa) als Feststoff, Flüssigkeit oder Gas definiert.
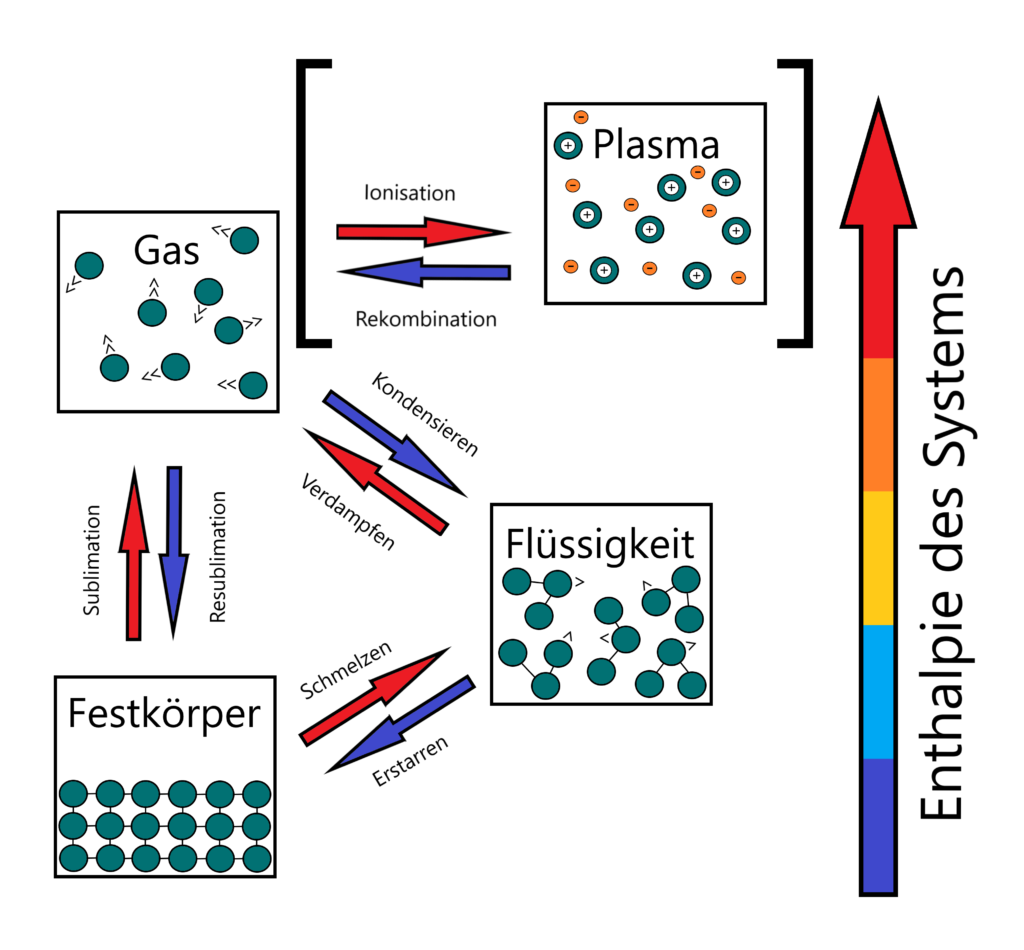
Darüber hinaus sind alle Reinstoffe in der Lage, ihren Aggregatzustand zu ändern, sofern nur ausreichend Energie in Form von Wärme und Druck hinzugeführt oder entnommen wird. In diesem Zusammenhang spricht man auch von der Enthalpie eines thermodynamischen Systems, bestehend aus der inneren Energie des Systems und dem Produkt aus Druck und Volumen.
Die Aggregatzustände stehen dabei in direkten Verbindungen zueinander, unterscheiden sich aber in den spezifischen Phasenübergängen. Mithilfe von genügend Energie lässt sich der gasförmige Aggregatzustand noch in einen Plasmazustand versetzen, zu den klassischen Aggregatzuständen zählt dieser üblicherweise allerdings nicht.
Der feste Aggregatzustand
- Der Stoff behält seine Form als auch sein Volumen
Die Teilchen im festen Aggregatzustand bewegen sich sehr langsam und schwingen um eine feste Position, meist um ihre eigenen Achsen. Erhöht sich die Temperatur, erhöht sich auch die Bewegung der Teilchen. Auch im Festkörper erhöhen sich dadurch die Abstände zwischen den Teilchen, aber die Form des Feststoffes bleibt unverändert. Ausgenommen sind Stoffe, die einer Dichteanomalie unterliegen, z.B. Wasser.
Festkörper werden nach der Beständigkeit der Ordnung ihrer Teilchen in kristallin und amorph unterschieden.
Die kristallinen Festkörper
Die meisten Feststoffe fallen in die Kategorie „kristallin“, sprich sie haben eine sehr gleichmäßige Struktur und ihre Teilchen sind in mehreren Dimensionen regelmäßig angeordnet. Ihre Bausteine zeichnen sich durch eine Fernordnung aus, dass heißt ihr Aufbau und ihre Anordnung wiederholen sich innerhalb des Festkörpers immer wieder. Ihre Anordnung geht über die direkt benachbarten Teilchen hinaus. Unterschieden wird hier hauptsächlich zwischen Einkristallen, bei denen der gesamte Festkörper aus einem Kristall besteht und polykristallinen Festkörpern, die aus einem Zusammenschluss vieler Einkristalle bestehen, aber außerhalb der jeweiligen Einkristalle ein ungeordnetes Ganzes bilden.
Die amorphen Festkörper
Amorphe Festkörper gleichen vom Prinzip ihres ungeordneten Aufbaus eher Flüssigkeiten. Im Gegensatz zu kristallinen Feststoffen verfügen sie lediglich über eine Nahordnung ihrer Teilchen, das heißt ihre räumliche Anordnung und Gruppierung ist üblicherweise nur auf unmittelbar benachbarte Teilchen beschränkt. Herstellen lässt sich der amorphe Zustand unter anderem durch das schnelle Abkühlen von Flüssigkeiten oder einer Schmelze. Der plötzliche Wärmeverlust verhindert, dass sich die Teilchen während des Kühlvorgangs regelmäßig anordnen können und es zur Kristallisation kommt. Bekanntestes Beispiel für ein amorphes Material ist wahrscheinlich Glas, welches man aus thermodynamischer Sicht als „gefrorene, unterkühlte Flüssigkeit“ bezeichnen kann.
Festkörper ändern ihre Form, aber nicht ihr Volumen
Feste Stoffe lassen sich aufgrund ihrer Struktur praktisch nicht über Kraft oder Druck verdichten. Sie lassen sich unter Umständen temporär verformen, zum Beispiel beim Zusammendrücken einer Spiralfeder, oder dauerhaft, wenn man beispielsweise Metall biegt. Übt man allerdings hohen Druck auf Festkörper aus, werden diese zwar in den meisten Fällen ihre Gestalt ändern (z.B. brechen, bersten, pulverisieren), jedoch nicht ihr Volumen.
Das Volumen eines Festkörpers lässt sich aufgrund seiner Struktur praktisch nicht durch Kompression verändern, wohl aber durch Wärme oder Abkühlung. Unter Wärmeeinfluss vergrößert sich das Volumen und der feste Körper dehnt sich aus. Eine Abkühlung lässt den Festkörper schrumpfen, auch unter das ursprüngliche Volumen bei Raumtemperatur.
Die Wärmeausdehnung spielt eine sehr große Rolle in vielen Bereichen der Technik und des Bauwesens, da mechanische Bauteile und Bauwerke so konstruiert werden müssen, dass eine Volumenänderung durch hohe oder niedrige Temperaturen nicht zu Konstruktionsschäden führt.
Eine Ausnahme dieser Regel bildet auch hier wieder das Wasser, da sich sein fester Aggregatzustand „Eis“ nicht durch Wärme ausdehnt, sondern schmilzt.
Der flüssige Aggregatzustand
- Der Stoff behält sein Volumen, aber seine Form passt sich der ihn umgebenden Form bzw. dem Raum an
Im Gegensatz zum Feststoff können sich die einzelnen Teilchen im flüssigen Aggregatzustand freier bewegen und gegenseitig verschieben. Je höher die Temperatur, desto schneller bewegen sich die Teilchen und desto geringer ist ihre gegenseitige Anziehungskraft. Anders als Feststoffe verlassen die Teilchen ab einer gewissen Temperatur ihre feste Ordnung und bewegen sich frei. Obwohl ihr Abstand durch die schnelleren Bewegungen etwas größer wird, hängen die Teilchen allerdings weiterhin zusammen.
Ähnlich wie amorphe Feststoffe verfügen Flüssigkeiten über eine Nahordnung ihrer Teilchen, per Definition sind diese in ständiger, nichtperiodischer Bewegung.
Formänderungen abhängig von Umgebung und Viskosität
Im flüssigen Aggregatzustand verteilen sich Stoffe üblicherweise gleichmäßig über ihre unmittelbare Umgebung, sofern sie nicht von einem Gefäß in Form gehalten oder anderweitig geleitet werden. Sie gelten per Definition als Stoffe, die ihre Form sehr einfach, ihr Volumen allerdings nur sehr schwer ändern. Der Widerstand gegenüber Formänderungen ist allerdings abhängig von der Viskosität der Flüssigkeit, ihre Zähflüssigkeit bestimmt maßgeblich, wie schnell ein flüssiger Stoff seine Form verändert. So zählt beispielsweise Pech ob seiner Eigenschaften als Flüssigkeit, ist allerdings bei Zimmertemperaturen derart hochviskos, dass man den Eindruck hat, er fließe überhaupt nicht.
Flüssigkeiten lassen sich nur schwer komprimieren
Das Volumen von flüssigen Stoffen lässt sich, ähnlich wie bei Feststoffen, nur bedingt durch Druck verringern. Sie sind zwar im Durchschnitt um etwa den Faktor 10 kompressibler als Festkörper, gelten jedoch auch als praktisch volumenstabil.
Würde man beispielsweise Wasser mit dem üblichen Druck von 200 bar Industriegasflaschen versetzen, ergäbe sich lediglich eine Erhöhung der Dichte von 1000 kg/m³ zu ca. 1005 kg/m³, was einer Kompression von etwa 0,5 % entspricht. Es gibt für viele Flüssigkeiten jeweils berechnete Kompressionsmodule, diese sind allerdings eher theoretischer Natur und werden bis auf einige technischen Anwendungen praktisch nicht angewandt.
Verringert man die Temperatur, verringert sich allerdings üblicherweise auch das Volumen von Flüssigkeiten (auch hier mit der Ausnahme von Wasser).
Der gasförmige Aggregatzustand
- Die Volumenbeständigkeit entfällt, das Gas füllt den zur Verfügung stehenden Raum in Gänze aus
Im gasförmigen Aggregatzustand sind die Teilchen in sehr schneller Bewegung und verteilen sich, soweit möglich, auf das ganze ihnen zur Verfügung stehende räumliche Volumen. Im Gegensatz zu Festkörpern oder Flüssigkeiten hängen die Teilchen jetzt nicht mehr zusammen, sondern sind weit voneinander entfernt. Werden sie räumlich begrenzt, prallen sie an den Wänden ab und ergeben daraus den Druck des Gases.
Bei gleicher Masse nimmt ein Stoff im gasförmigen Aggregatzustand unter Normalbedingungen den etwa tausend- bis zweitausendfachen Raum von Festkörper und Flüssigkeit ein, sofern ihm ausreichend Raum zur Verfügung steht. Diese Eigenschaft bedingt, dass sich Gase, im Gegensatz zu flüssigem und festem Aggregatzustand, üblicherweise über Druck sehr stark komprimieren lassen. Ihr Volumen nimmt bei Druckerhöhung dementsprechend stark ab.
Bei Gasen verringert hoher Druck den Abstand zwischen den Teilchen und sie werden (in den meisten Fällen) flüssig. Das Volumen lässt sich dann fast nicht mehr weiter verringern, weil die Teilchen schon sehr nah beieinander sind.
Effektive Lagerung dank Verdichtung durch Druck oder Abkühlung
Die Komprimierung und tiefkalte Verflüssigung von Gasen spielt eine sehr große Rolle in der chemischen Industrie, beziehungsweise der Gewinnung und Verwendung technischer Gase. Im Gegensatz zu Festkörpern und Flüssigkeiten lassen sich Gase extrem komprimieren und so für viele Anwendungen nutzbar machen.
So befinden sich in einer handelsüblichen 5 kg Propan Gasflasche dank dieser Eigenschaften bei 8 bar Druck etwa 2452 Liter Gas.
Technische Gase werden üblicherweise mit einem Druck von 200 – 300 bar in Gasflaschen abgefüllt. Eine 10l Argon Gasflasche beinhaltet bei 200 bar so etwa 2130 Liter gasförmiges Argon.
Verflüssigt man das Gas und lagert es unterhalb seines Siedepunkts von -186 °C in großen Kryotanks, sogenannten Kaltvergasern, lassen sich aus einem Liter flüssigen Argon sogar 835 Liter Argon Gas gewinnen.
Das Wasser – Eine Ausnahme vieler Regeln
Fast allen Menschen sind die Phasenübergänge der Aggregatzustände dank Wasser bekannt, ohne darüber nachzudenken.
So kennt fast jeder sowohl das Erstarren (Gefrieren) von Wasser und Schmelzen von Eis, als auch das Verdampfen von Wasser und Kondensieren von Wasserdampf.
Die Sublimation und Resublimation von Wasser, also der direkte Übergang von fester zu gasförmiger Phase und umgekehrt sind etwas seltener zu beobachten. Hängt man nasse Wäsche bei Minusgraden im Winter auf, wird diese trotzdem trocknen. Das Wasser gefriert zu Eis und sublimiert dann, ohne vorher flüssig geworden zu sein.
Wasserdampf wiederum bildet im Winter in seltenen Fällen Raureif, wenn die Luftfeuchtigkeit über 90% beträgt und die Temperatur -8° C und weniger. Der Wasserdampf der Luft resublimiert in diesen Fällen direkt zu Eiskristallen.
Die Dichteanomalie des Wassers
Im Gegensatz zu den meisten anderen Stoffen erhöht sich die Dichte von Wasser nicht mit abnehmender Temperatur, Wasser hat die höchste Dichte unter Normaldruck bei 3,98 °C.
Diese Dichteanomalie existiert aufgrund der Struktur der Wassermoleküle, genauer über ihre Verkettung von Wasserstoffbrückenbindungen. Diese benötigen im festen Aggregatzustand zwar mehr Raum, erreichen ihre maximale Dichte allerdings schon im flüssigen Zustand, eben bei etwa 3,98 °C.
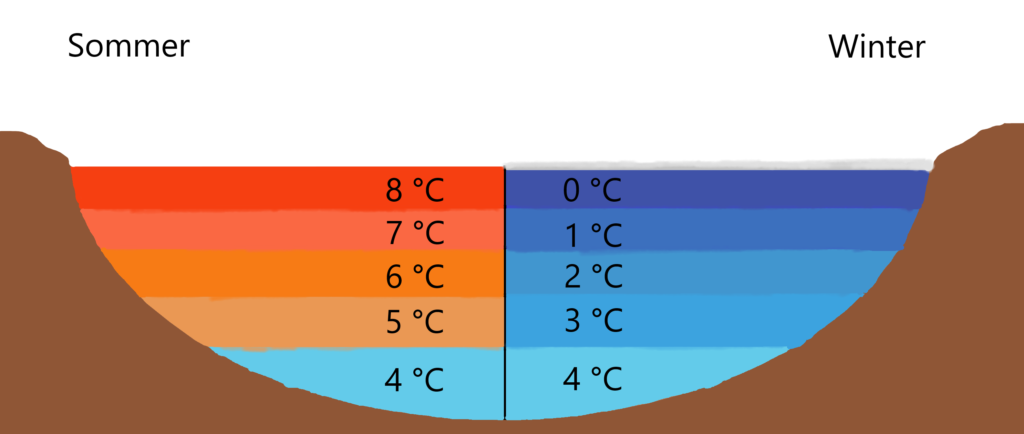
So erklärt sich, warum Gewässer im Winter von der Oberfläche nach unten „durchfrieren“ und nicht umgekehrt, da das eigentlich wärmere Wasser durch seine höhere Dichte absinkt. Dank dieser außergewöhnlichen Eigenschaft herrschen am Gewässergrund auch im tiefsten Winter Temperaturen, die organisches Leben im Wasser erlauben. Die sich oben bildende Eisschicht schützt und isoliert zusätzlich vor weiterer Auskühlung. Diese Dichteanomalie des Wassers hat die Bildung höherer Lebensformen auf der Erde vereinfacht, wenn nicht gar erst möglich gemacht.
Die Änderung der Aggregatzustände: Phasenübergänge durch Wärme und Druck
Entscheidend für den Aggregatzustand eines Stoffes und seine spezifischen Phasenübergänge sind maßgeblich hinzugefügte oder freigesetzte Wärme sowie der Umgebungsdruck. In Phasendiagrammen lassen sich anhand der jeweiligen Phasengrenzlinien ablesen, unter welchen Übergangsbedingungen (Temperatur und Druck) der Stoff seinen Aggregatzustand wechselt.
Grundsätzlich unterscheiden sich die Phasenübergänge, ob Wärmeenergie hinzugefügt oder freigesetzt wird. Jeder der drei Aggregatzustände hat jeweils zwei Phasenübergänge mit Zugabe thermischer Energie und zwei mit Abgabe, die sich wie folgt verteilen:
| Aggregatzustand (von / nach) | Festkörper | Flüssigkeit | Gas |
|---|---|---|---|
| Festkörper | – | Schmelzen | Sublimation |
| Flüssigkeit | Erstarren | – | Verdampfen |
| Gas | Resublimation | Kondensieren | – |

Phasenübergang durch Wärmabgabe:
Erstarren (Gefrieren) – Der Stoff geht vom flüssigen in den festen Aggregatzustand über, meistens aufgrund von Abkühlung. Die Teilchen verlangsamen sich und ihre Abstände werden immer geringer. Erreichen sie ihre Erstarrungstemperatur sind sie einander wieder so nah, dass sie sich gegenseitig blockieren und wechselwirkend anziehen. Sie nehmen jetzt wieder eine feste Position ein und der Stoff ist fest. Im Falle von Reinstoffen und konstantem Druck ist diese Temperatur immer gleich, so hat jeder Reinstoff einen spezifischen Gefrierpunkt, der gleichzeitig auch exakt seinem Schmelzpunkt entspricht.
Kondensieren – Der Stoff geht vom gasförmigen in den flüssigen Aggregatzustand über und gibt dabei Wärmeenergie an seine Umgebung ab. Die abgegebene Energiemenge entspricht dabei derselben, die ursprünglich für die Verdampfung benötigt wurde (Kondensationsenthalpie = Verdampfungsenthalpie). Die für die Kondensation benötigten Druck- und Temperaturwerte werden als Kondensationspunkt bezeichnet. Bekannteste Beispiele der Kondensation sind Wetterphänomene wie die Wolkenbildung, Nebel und Tau oder Luftfeuchtigkeit, die an einer kalten Flasche zu Wasser kondensiert. Auch in Kühlkreisläufen von Kältemaschinen und sogar Wärmepumpen spielt die Verdampfung von Kältemitteln mit anschließender Druckerhöhung und Kondensation eine große Rolle beim Transport thermischer Energie.
Resublimation – Der Stoff geht am sogenannten Sublimationspunkt direkt vom gasförmigen in den festen Aggregatzustand über, da Druck und Temperatur eine flüssige Phase nicht erlauben. In diesem Fall entspricht die Sublimationsenthalpie der Summe aus Schmelz- und Verdampfungsenthalpie. Bekanntestes Beispiel für dieses Phänomen ist wahrscheinlich Reif, der im Winter als bodennahe Eisablagerung auftritt. Hier resublimiert Wasserdampf zu Eis, wenn der Taupunkt auf den Oberflächen unterhalb vom Gefrierpunkt des Wassers liegt.
Phasenübergang durch Wärmezufuhr:
Schmelzen – Der Stoff geht vom festen in den flüssigen Aggregatzustand über, meistens durch Wärmezufuhr oder im Zusammenspiel mit einer Senkung des Drucks. Die Teilchen werden immer schneller und ihr Abstand erhöht sich, bis sie teilweise aus ihrer festen Struktur brechen und in kleineren Gruppen frei beweglich werden. Die Temperatur bleibt während des Schmelzens konstant, da die eingebrachte Energie in den Phasenübergang investiert wird.
Verdampfen – Der Stoff geht vom flüssigen in den gasförmigen Aggregatzustand über. Über Zugabe thermischer Energie werden die Teilchen immer weiter beschleunigt, bis sie genügend Energie haben, um vom flüssigen in den gasförmigen Zustand zu wechseln. Beim Phasenübergang entziehen sie dem Gesamtsystem etwas Wärmeenergie und kühlen die verbliebene Flüssigkeit, so dass üblicherweise eine konstante Wärme- beziehungsweise Energiezugabe erfolgen muss, um die Verdampfung aufrechtzuerhalten. Die Temperatur dieses Prozesses bleibt so lange gleich, bis alle Teilchen der flüssigen Phase in die gasförmige Phase übergetreten sind.
Üblicherweise unterscheidet man zwischen Verdunstung und Verdampfung, wobei Verdunstung den Übergang in den gasförmigen Zustand unterhalb der Siedetemperatur eines Stoffes beschreibt. Verdampfen beschreibt meistens die Erhöhung der Temperatur eines Stoffes über den stoffspezifischen Siedepunkt.
Sublimation – Der Stoff geht vom festen Aggregatzustand direkt in den gasförmigen Zustand über, ohne sich vorher zu verflüssigen. Der grundsätzliche Prozess ähnelt dem der Verdampfung, entscheidend ist hier der Umgebungsdruck. Die Sublimation findet nur unter Temperatur- und Druckbedingungen statt, die eine Verflüssigung des Stoffes nicht erlauben. In diesem Zusammenhang spricht man auch vom Sublimationspunkt.
| Stoff | Schmelztemperatur | Siedetemperatur | Aggregatzustand bei -10°C (Gefriertruhe) | Aggregatzustand bei 20°C (Raumtemperatur) | Aggregatzustand bei 200°C (Backofen) |
|---|---|---|---|---|---|
| Wasser | 0°C | 100 | fest | flüssig | gasförmig |
| Brom | -7°C | 59°C | fest | flüssig | gasförmig |
| Caesium | 28 °C | 671 °C | fest | fest | flüssig |
| Quecksilber | -39 °C | 357 °C | flüssig | flüssig | flüssig |
| Eisen | 1535 °C | 2750 °C | fest | fest | fest |
| Sauerstoff | -219 °C | -183 °C | gasförmig | gasförmig | gasförmig |
| Stickstoff | -210 °C | -196 °C | gasförmig | gasförmig | gasförmig |
| Argon | -189 °C | -186 °C | gasförmig | gasförmig | gasförmig |
Phasenübergänge der Aggregatzustände außerhalb der täglichen Wahrnehmung
Anhand der Tabelle lässt sich gut erkennen, dass die Phasenwechsel sehr vieler Stoffe in Temperatur- und Druckbereichen stattfinden, die sich unter Normalbedingungen, beziehungsweise im menschlichen Alltag, nicht beobachten lassen.
So gibt es mit Brom und Quecksilber auch lediglich zwei natürliche Elemente, die unter Normbedingungen flüssig sind. Hauptsächlich das Wasser und seine vielfältigen Aggregatzustände und Phasenübergänge sind überall zu finden.
Die stoffspezifischen Siede- und Schmelzpunkte lassen sich allerdings trotzdem vielfältig nutzen und anwenden. So spielt die Siedetemperatur eine sehr wichtige Rolle bei der Gewinnung von Stickstoff, Sauerstoff und den Edelgasen, maßgeblich Argon. Für deren Gewinnung wird die Umgebungsluft mit Hilfe großer Luftzerlegungsanlagen sehr stark abgekühlt, bis sie sich bei etwa -170 °C verflüssigt. Mittels Rektifikationssäulen macht man sich im nächsten Schritt die unterschiedlichen Siedepunkte der einzelnen Gase zu Nutze und trennt sie voneinander.
Während Sauerstoff bei -183 °C siedet, siedet Stickstoff bereits bei -196 °C. Der Stickstoff verdampft früher als der Sauerstoff und die Gase lassen sich entsprechend ihrer unterschiedlichen Siedetemperaturen fraktionieren. Die Edelgase Argon, Krypton, Neon und Xenon werden auch über dieses Verfahren gewonnen. Mit Ausnahme von Argon (0,93% in der Umgebungsluft) ist ihr Gehalt in der Luft allerdings so gering, dass sie erst mehrere aufwendige Anreicherungsprozesse durchlaufen müssen.
Aggregatzustände im Druck-Temperatur-Phasendiagramm
Phasendiagramme werden in der Thermodynamik häufig verwendet, um die stoffspezifischen Zustandsräume beziehungsweise ihre Phasengrenzlinien in einem zweidimensionalen Koordinatensystem darzustellen. So ist es basierend auf Druck und Temperatur möglich, Reinstoffen bestimmte Flächen in diesem Diagramm zuzuweisen, innerhalb deren Grenzen sie entweder fest, flüssig oder gasförmig sind.
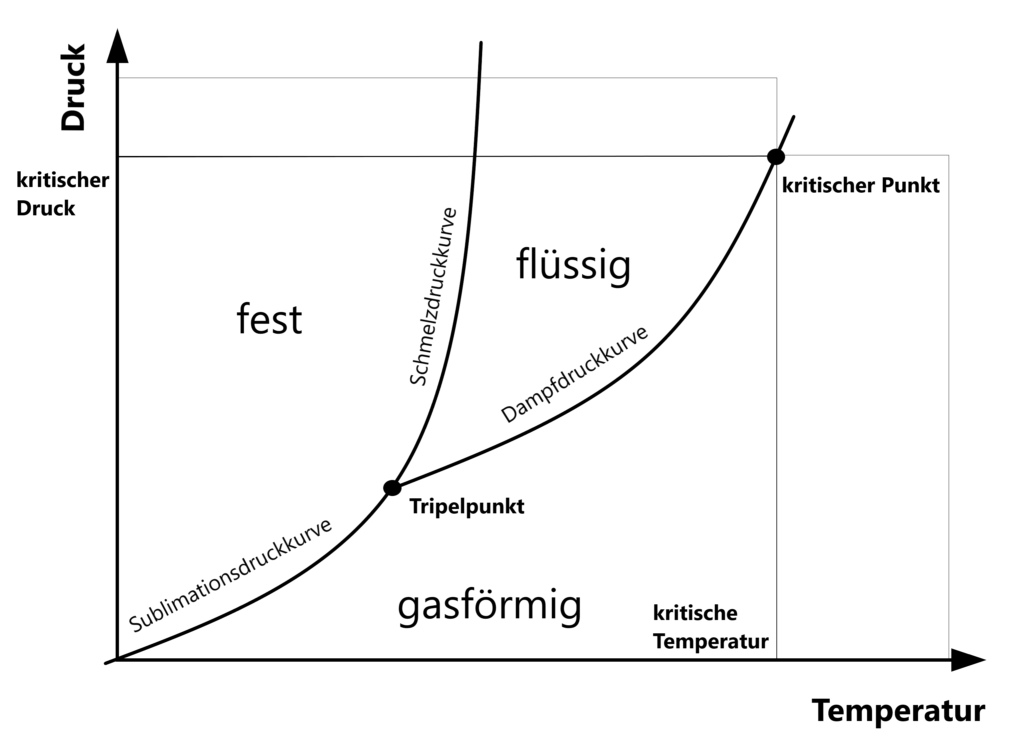
Der Tripelpunkt stellt in einem p-T-Diagramm (p = Druck, T=Temperatur) den Zustand eines Reinstoffes dar, der unter diesen speziellen Druck- und Temperaturbedingungen in einem thermodynamischen Gleichgewicht steht. An diesem Punkt kann ein Stoff sowohl fest, flüssig als auch gasförmig sein.
Von diesem Punkt aus geht die Schmelzdruckkurve zwischen fester und flüssiger Phase nach oben und die Dampfdruckkurve zwischen flüssiger und gasförmiger Phase nach rechts. Vor dem Tripelpunkt befindet sich die Sublimationskurve zischen fester und gasförmiger Phase.
Wichtig in diesem Zusammenhang ist die Überlagerung mehrerer Phasengrenzlinien, sogenannter Binodalen. So besteht die Schmelzdruckkurve aus dem Koexistenzgebiet der Schmelzkurve und der Erstarrungskurve, die dort genau übereinander liegen.
Gleiches gilt für die Siedekurve und die Kondensationskurve, die sich als Dampfdruckkurve überlagern und die Sublimationskurve und Resublimationskurve, die die Sublimationsdruckkurve bilden.
Mit steigendem Druck und immer höherer Temperatur gleichen sich die Dichte des Gases und der Flüssigkeit immer näher an. Ist der kritische Punkt erreicht, lässt sich nicht mehr zwischen der Dichte flüssiger und gasförmiger Phase unterscheiden und die Unterschiede zwischen beiden Aggregatzuständen hören auf, zu existieren. Das obere Ende der Dampfdruckkurve ist an diesem Punkt erreicht.
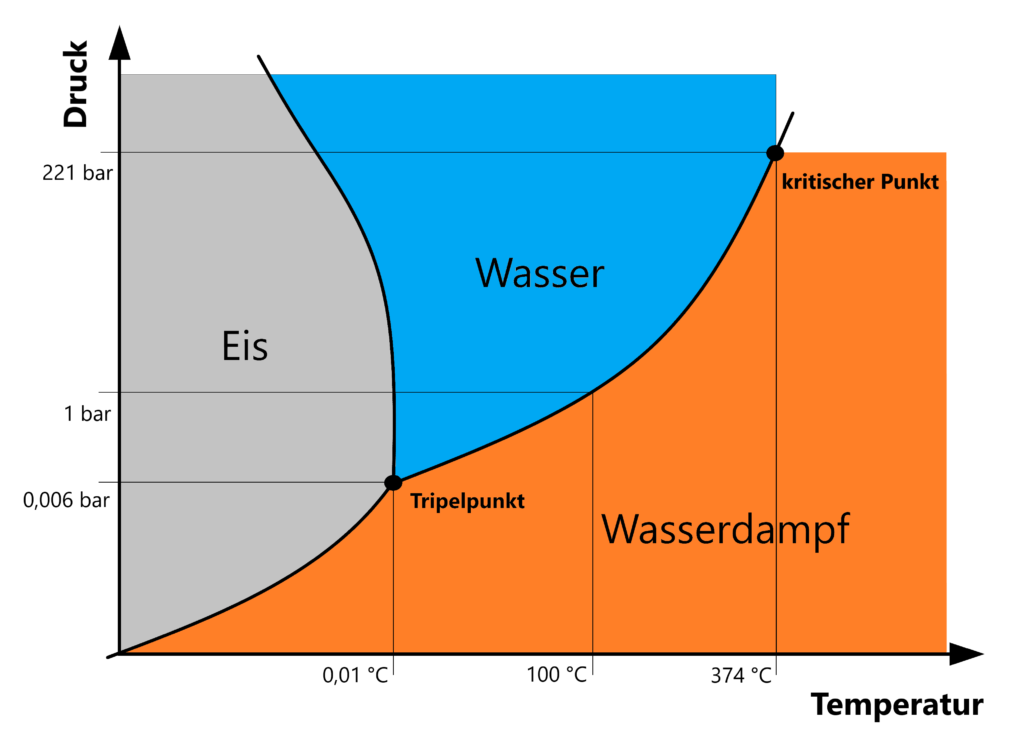
Auf dem Phasendiagramm von Wasser lässt sich die Dichteanomalie auch erkennen, die Schmelzdruckkurve (ausgehend vom Tripelpunkt nach oben) zwischen fester und flüssiger Phase ist in diesem Fall negativ.
Im Normalfall, also bei Stoffen ohne Dichteanomalie, verläuft die Schmelzdruckkurve zwischen fester und flüssiger Phase positiv.
